Nell’ambito del WP4, Sviluppo di piattaforma di Screening, il consorzio ritiene di aver individuato e messo a punto le condizioni per studiare le alterazioni indotte dalle mutazioni sul gene OPA1.
Questi protocolli di screening sono utilizzabili anche per mutazioni su altri geni che inducono il Parkinson e sono applicabili a sistemi di HCS in completa automazione e quindi utili per campagne di screening farmacologico volte alla neuroprotezione nella malattia di Parkinson.
Di seguito i dati in dettaglio.
Studio del potenziale di membrana mitocondriale
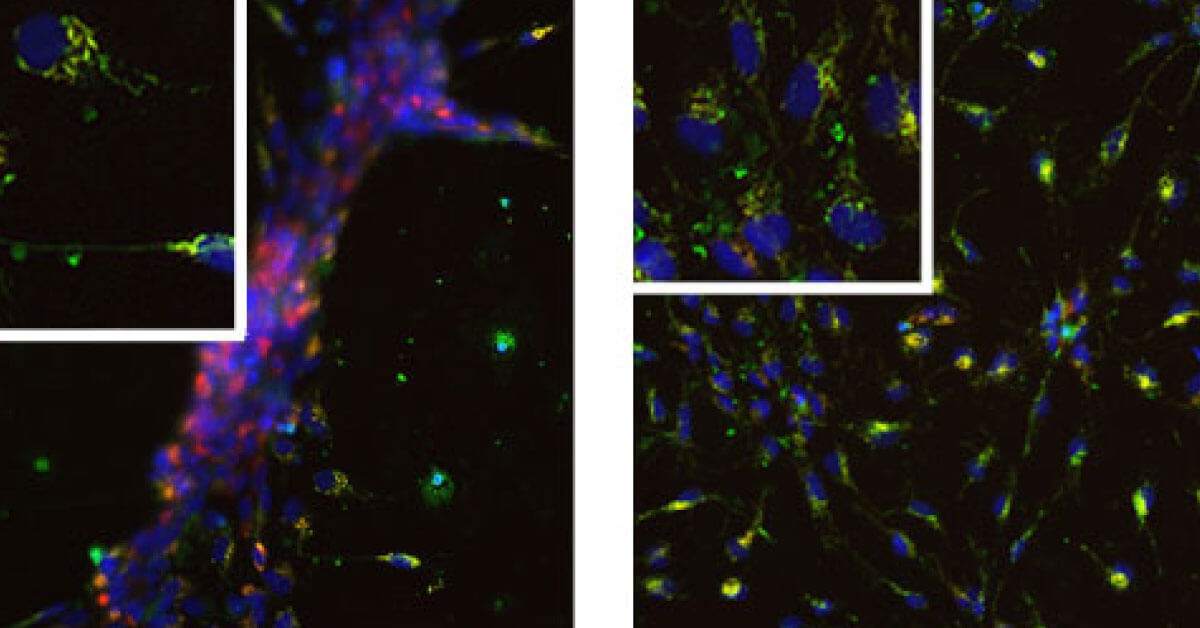
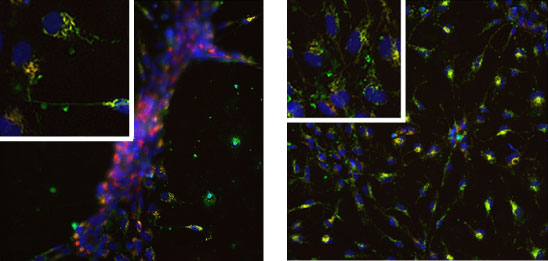
Sono state utilizzate cellule iPS (cellule pluripotenti staminali indotte) differenziate in cellule precursori neuronali (neuronal precursor cells, NPC). Le cellule derivanti da pazienti affetti da malattia di Parkinson sono particolarmente sensibili allo stress ossidativo. Le conseguenti alterazioni del potenziale di membrana mitocondriale possono essere monitorate in cellule vitali utilizzando il tracciante fluorescente TMRM, i cui livelli di fluorescenza rivelano variazioni dello stato energetico mitocondriale (Fig. 1).
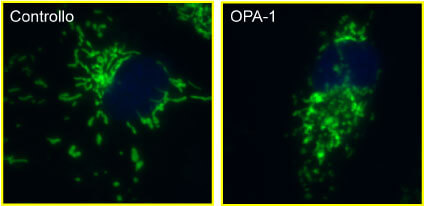
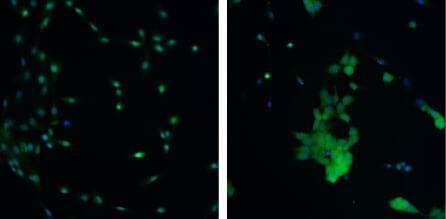
Inoltre, l’utilizzo di un marcatore mitocondriale (Mitotracker), ha dimostrato un alto livello di frammentazione mitocondriale nelle cellule mutate nel gene OPA-1 (Fig. 2).
Strategia analitica
Il segnale del potenziale mitocondriale e stato filtrato spazialmente in base al segnale della morfologia mitocondriale ottenuta mediante mitotracker. Un esempio dell’analisi è illustrato nella figura 3.

Risultati
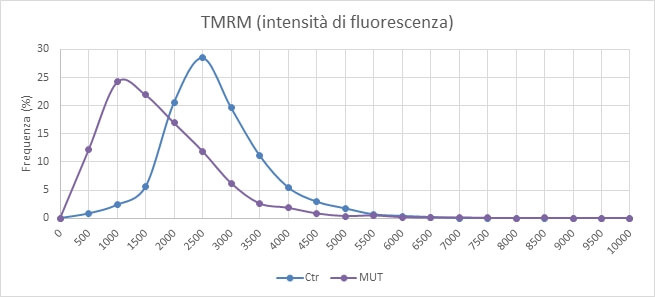
I livelli di potenziale mitocondriale risultano sensibilmente diversi tra i campioni controllo (Ctr) e quelli con mutazione nel gene OPA1 (MUT) (Fig. 4).
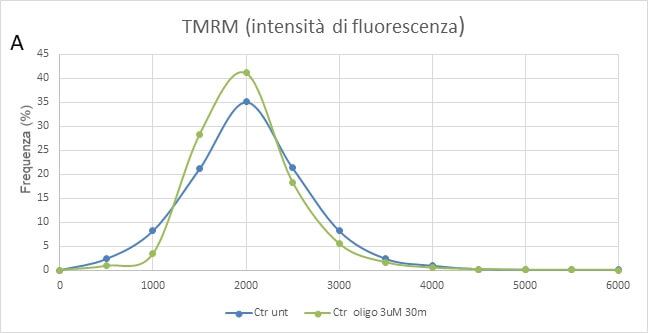
Studi farmacologici
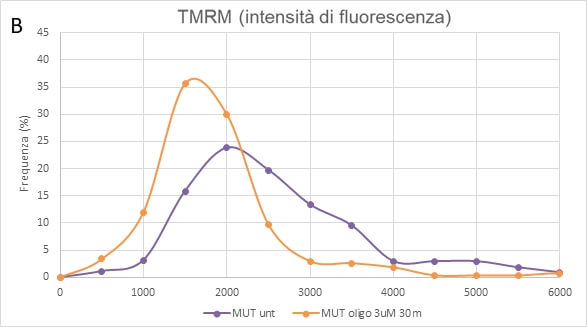
Il trattamento con oligomicina, un inibitore specifico del complesso V della catena respiratoria mitocondriale, non ha un effetto significativo sulle cellule NPC Ctr (A), mentre provoca una forte depolarizzazione della membrane mitocondriale nelle cellule mutate (B). Questo indica che le cellule da paziente sano hanno una maggiore sensibilità allo stress ossidativo e usano principalmente i complessi I e II della catena respiratoria mentre le cellule con mutazione nel gene OPA1 utilizzano principalmente l’idrolisi dell’ATP sul complesso V (Fig. 5).
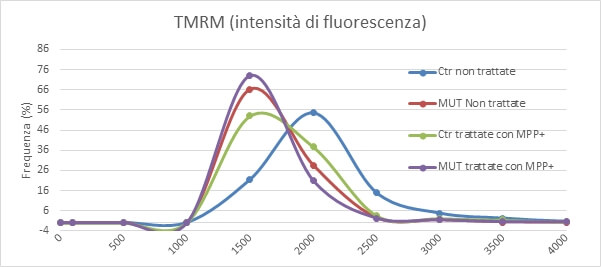
Il trattamento con MPP+, un inibitore del complesso I della catena respiratoria, induce una diminuzione del potenziale mitocondriale nelle cellule controllo (Ctr) mentre non ha effetto sulle cellule mutate nel gene OPA1 (MUT) (Fig. 6), a conferma che le cellule da paziente sano usano il complesso I della catena respiratoria a differenza delle cellule con mutazione nel gene OPA1.
Studio dei livelli di stress ossidativo cellulare
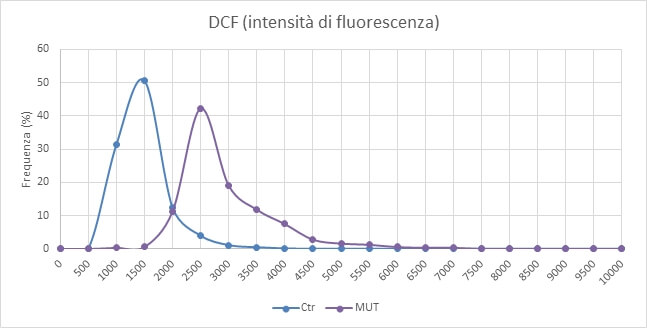
Le cellule derivanti da pazienti affetti da malattia di Parkinson vanno incontro a fenomeni di stress ossidativo con conseguente aumento dei radicali liberi cellulari. Il livello di questi radicali liberi può essere monitorato nelle cellule utilizzando il DCF, un colorante la cui intensità di fluorescenza varia al variare della concentrazione dei radicali liberi citosolici (fig. 7).
Si può notare che i livelli di stress ossidativo risultano sensibilmente inferiori nei campioni controllo (Ctr) rispetto a quelli con mutazione nel gene OPA1 (Fig. 8).